第九篇HD文章--前哨淋巴结中的淋巴管因乳腺癌发生重塑
原创第九篇HD文章--前哨淋巴结中的淋巴管因乳腺癌发生重塑
原创
追风少年i
发布于 2026-01-10 15:05:11
发布于 2026-01-10 15:05:11
作者,Evil Genius
关于HD的文章,从24年下半年开始大量引入,到如今接近1年半的时间了,发表的文章并不算多,其实跟visium刚开始引入国内的情况差不多,最大的卡点在于,拿到数据之后,如何分析阐明自己的生物学问题?
任何事情,先机很重要,一旦成熟了,机遇也就没了,单细胞数据刚引入国内的时候也没人会分析,所以一个样本做好注释,就能发nature;visium低精度一开始大家也不知道如何分析,经过培训大家明白了分析思路,但是发文章的先机已失,同样的情况也会在HD数据上重演。
HD数据的注释策略已经有了详细的讲解,不过随着认识的深入,有些内容需要更新。

今天我们分享文献

知识积累
癌症转移至前哨淋巴结往往是疾病潜在进展的首个标志。
淋巴系统在免疫系统中起着关键作用,它能高效地将抗原和免疫细胞运输至淋巴结,从而及时启动免疫应答或产生抗原免疫耐受。然而,癌细胞可利用这一运输网络促进其快速扩散。癌细胞通过淋巴管转移至引流淋巴结,在其中定植并诱导针对肿瘤抗原的免疫耐受。淋巴结转移还能保护癌细胞在后续的全身扩散中免受氧化应激损伤。在临床上,前哨淋巴结转移是预测患者死亡率的关键指标。因此,理解癌细胞向淋巴结迁移并促进转移耐受的机制至关重要。
癌细胞具有高度运动性,并能调控其他细胞类型以促进转移。一个已知的机制是肿瘤诱导的淋巴管新生:在原发性肿瘤中,癌细胞或巨噬细胞等分泌 VEGF-C,诱导淋巴管内皮细胞增殖与出芽,从而增强癌细胞向淋巴结的转移能力。另一淋巴管新生因子 VEGF-D 则通过调节前列腺素生成,调控集合淋巴管的扩张及后续转移。此外,除原发肿瘤的淋巴管新生与癌细胞扩散外,有证据表明癌细胞可调节引流淋巴结中的淋巴管,以利于其到达。
结果1、人淋巴结淋巴管内皮细胞的单细胞比较分析
样本来源:取自乳腺切除患者的腋窝淋巴结,分选PDPN⁺CD31⁺细胞富集LECs。
肿瘤对LECs的主动调控:癌细胞通过改变淋巴结微环境,诱导LECs表型转变(如PDPN上调、亚群比例变化),可能促进免疫逃逸或转移定植。
功能异质性的新发现:LECs亚群具有明确的定位与功能分工(如免疫调节、抗原转运、结构支持),转移过程会打破这种平衡。
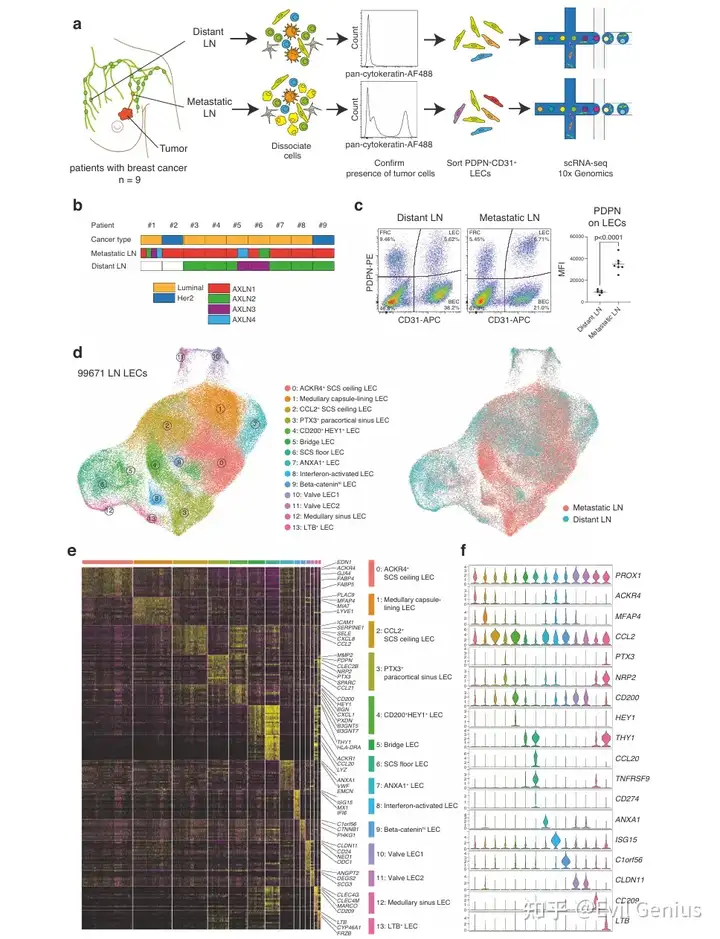
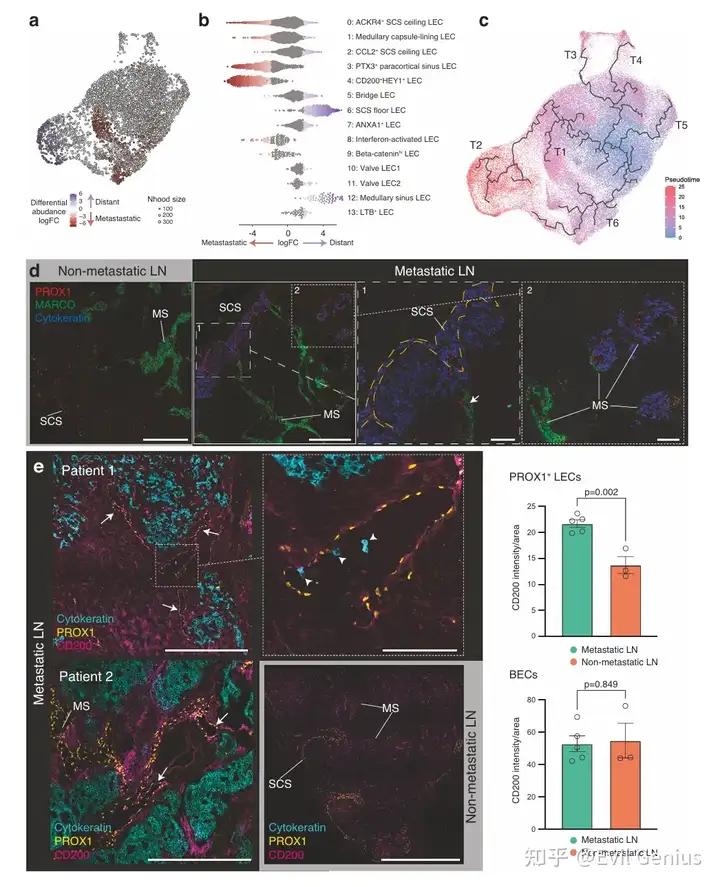
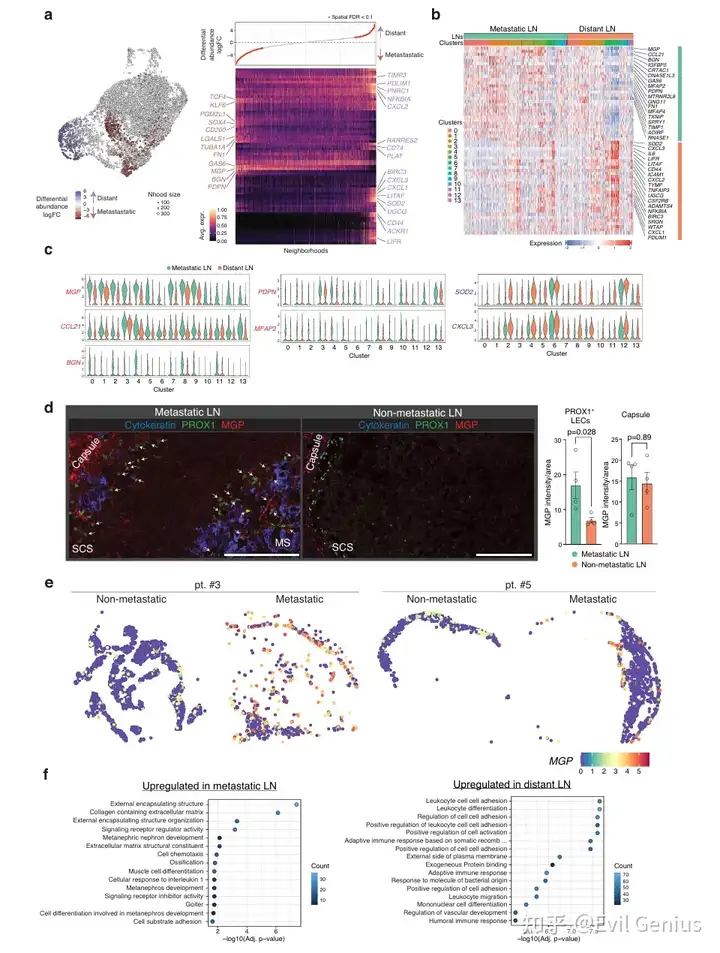
结果2、淋巴结转移重塑淋巴管内皮细胞亚群
乳腺癌淋巴结转移会显著改变淋巴结内淋巴管内皮细胞亚群的组成与分布:
亚群比例变化:
增加:转移性淋巴结中,副皮质窦LECs(cluster3) 和 CD200⁺HEY1⁺LECs(cluster4) 显著增多。
减少:转移性淋巴结中,被膜下窦底部LECs(cluster6) 和 髓窦LECs(cluster12) 明显减少。
不变:被膜下窦顶部LECs(cluster0-2)等亚群比例基本维持不变。
这一变化趋势在不同分子亚型(腔面型和HER2阳性)乳腺癌患者中均存在。
分化轨迹偏移:
轨迹分析显示,LECs存在多条分化路径。
淋巴结转移会优先驱动LECs向T1(最终分化为CD200⁺HEY1⁺LECs) 的谱系分化,而非T2(最终分化为SCS底部LECs) 谱系。
功能表型改变:
免疫抑制微环境:在转移性淋巴结中,PROX1⁺LECs上的CD200 表达显著升高。体外实验证实,LECs上的CD200具有抑制T细胞活化的免疫抑制功能。
结构改变:表达CD200的LECs在转移性淋巴结中形成毛细血管样淋巴管,并观察到癌细胞存在于这些管腔内,提示其可能成为癌细胞扩散的通道。
髓窦LECs功能受损:在含有癌细胞的髓窦区域,尽管LECs身份标记PROX1仍在表达,但重要的MARCO(巨噬细胞受体)表达丢失。这与髓窦LECs亚群(簇12)的减少相一致,该亚群通常高表达炎症因子并负责维持窦巨噬细胞,对肿瘤免疫至关重要。
淋巴结转移并非被动过程,而是会主动重塑局部淋巴管生态系统。这种重塑表现为具有免疫抑制和促转移潜能的LEC亚群(如CD200⁺HEY1⁺LECs)扩增,同时具有抗肿瘤免疫功能的LEC亚群(如SCS底部和髓窦LECs)减少,从而为癌细胞存活、扩散和免疫逃逸创造了有利的微环境。
高分辨率空间转录组学揭示LECs重塑(10X HD)
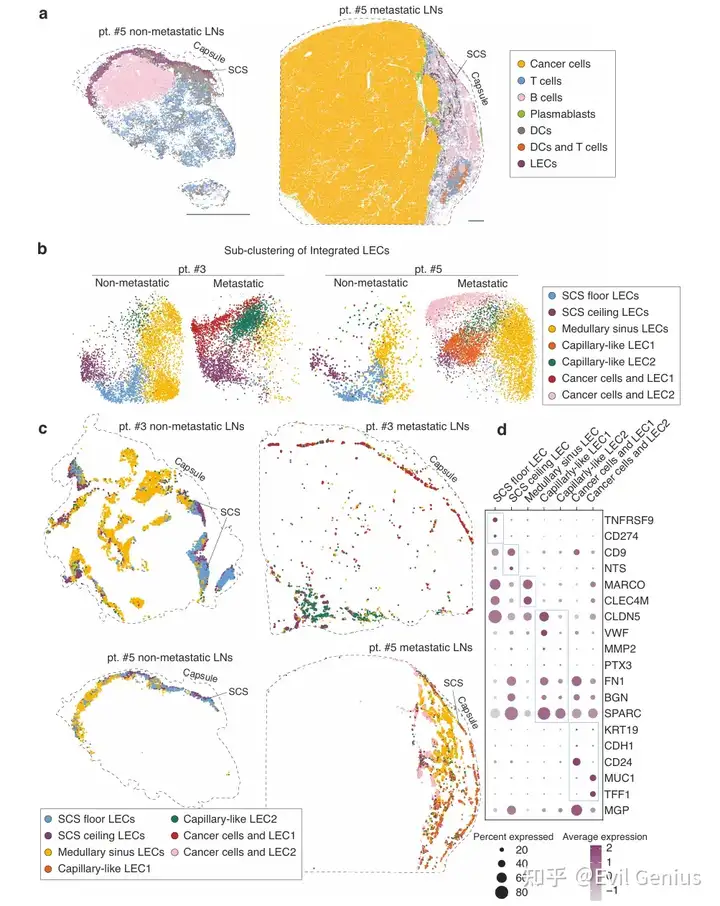
结果3、淋巴结转移诱导LECs的转录组重塑
转移相关基因表达特征
上调基因:在转移性淋巴结富集的LECs中,MGP(基质Gla蛋白) 是最显著上调的基因之一。其他共同上调的基因包括GAS6、BGN、PDPN、TCF4和CD200。这些基因在大多数LEC亚群中普遍上调,提示其作用具有广泛性。
功能富集:上调基因显著富集于 “含胶原的细胞外基质重塑” 和 “外部包被结构” 等通路。关键分子包括MGP、BGN、MFAP2、MFAP4和FN1,表明转移性LECs积极参与细胞外基质的重构。
空间验证:免疫组化与空间转录组数据均证实,MGP在非转移淋巴结中主要表达于被膜和小梁,而在转移淋巴结中则在PROX1⁺ LECs上特异性上调。
免疫功能相关基因下调
下调基因:在转移性淋巴结中耗竭的LECs高表达一系列炎症相关基因,如NFKB-IA、CXCL1-CXCL3、CD74、CD44、SOD2、IL6等。
功能富集:下调基因显著富集于 “白细胞细胞间粘附” 和 “白细胞迁移” 等通路。这表明转移性淋巴结中正常的白细胞运输功能受损。
关键免疫调节分子缺失:由SCS底部LECs特异性表达的免疫检查点分子CD274(PD-L1) 在转移淋巴结中显著下调。该表达模式具有细胞特异性,在其他淋巴结细胞(如巨噬细胞、BECs)中未检测到。
改变的特定性与普遍性
与炎症的区别:对比公开的小鼠及人类炎症淋巴结scRNA-seq数据集发现,单纯的炎症不会引起类似转移所诱导的LEC亚群组成改变及MGP/BGN等特征基因的上调。这表明观察到的重塑是肿瘤转移特异性的。
超越淋巴结环境:在人类乳腺癌原发灶的公开数据中同样发现,肿瘤内部LECs的MGP表达高于瘤周区域。这提示MGP介导的LEC重塑机制可能不仅限于淋巴结,而是肿瘤微环境中一个更普遍的现象。
淋巴结转移诱导LECs发生特异性的转录重编程:其核心特征是促基质重塑基因(如MGP)的上调与介导免疫细胞运输的炎症基因的下调。这种重编程共同导致了淋巴结微环境向免疫抑制和促转移状态的转变,且这种改变与单纯的炎症反应有本质区别。
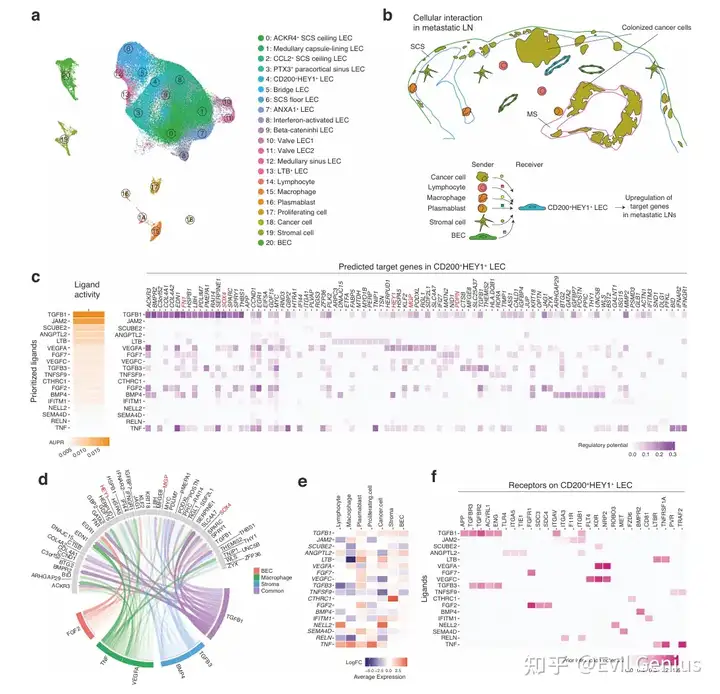
结果4、基于NicheNet的细胞间通讯分析预测转移性淋巴结淋巴管重塑机制
细胞间通讯分析揭示了淋巴结转移微环境中,癌细胞、巨噬细胞、基质细胞等通过分泌TGF-β、VEGF-A/C等关键因子,主动调控LECs(特别是CD200⁺ HEY1⁺ LECs亚群)的转录程序,驱动其向促转移表型重塑。
结果5、乳腺癌细胞条件培养基改变人淋巴管内皮细胞转录组
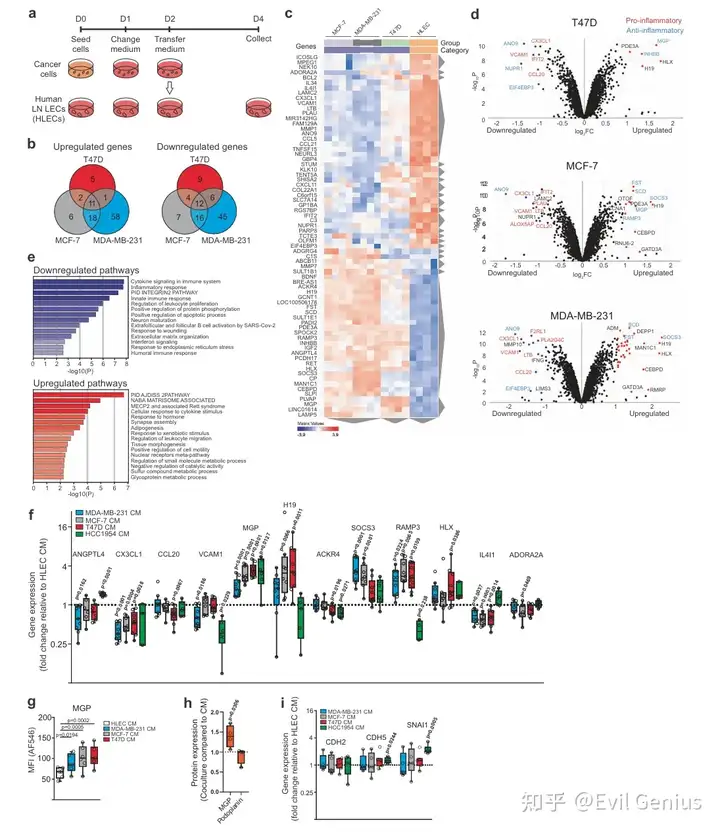
下面都是实验验证的部分,我们来看看HD方法部分


生活很好,有你更好
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
评论
登录后参与评论
推荐阅读
目录

