文献分享--成纤维细胞TGFβ信号的空间模式构成类风湿关节炎治疗抵抗的基础(Xenium 5k)
原创文献分享--成纤维细胞TGFβ信号的空间模式构成类风湿关节炎治疗抵抗的基础(Xenium 5k)
原创
追风少年i
发布于 2026-01-18 11:04:57
发布于 2026-01-18 11:04:57
作者,Evil Genius
HD好还是xenium好?xenium特别贵是真的。
有人问我天天看文献不觉得无聊么,说实话了,啥也不做就会感觉到焦虑,看文献这会儿注意力转移了,焦虑感就几乎没有了。
以前还打打游戏,和朋友一起聚聚,现在身边一个朋友也叫不出来,对游戏也丧失了兴趣,估计大家也跟我差不多。
有一篇说到工作以后再发文章非常难(指共一),有人我问是不是找公司经验丰富的生信人员合作发文章会快一点,我只能说分析部分会快一点,最好建立长久的信任,像我领导和外国医生的合作,第一篇其实分析花费了很多,耗时2年见刊,大家觉得一个生信总监,2年陪课题组分析,而且随叫随到这种,应该给多少费用呢?给大家一个参考,当时他的工资一个月2万多,就算一半,2年也需要20万啊,当然换成美元大约3万,感觉还好,第一次建立了互信之后,后面的合作都是免费的,作者给共一,有一篇我领导全程没参与,也给了共一,其中的问题大家需要考虑,有多少课题组是可以为一个分析人员一直付费的,哪怕这个月没用到分析?又有多少生信工作人员愿意接受课题组的高压模式,不停的修改,一直催结果的?结果不好,到底是分析的责任,还是课题组的无理要求呢?可见啊,好的合作伙伴多么重要,见到的大部分深度合作项目都是无疾而终的,这还没算服务器配置等硬件要求了。
当然了,像我领导这么有理想的也很少,大部分就是像我一样混口饭吃,能把工作处理好就不错了,大家如果真的有理想,直接读博吧。
今天我们来分享文献

知识积累
滑膜成纤维细胞作为间充质细胞,在RA中会扩增并进入病理状态,驱动炎症和关节损伤。单细胞研究显示滑膜成纤维细胞具有高度异质性,其特定基因特征可预测治疗失败。
研究通过亚细胞分辨率空间转录组技术,对初发RA患者治疗前后滑膜活检样本进行分析,发现:
在未缓解患者基线样本中,促纤维化成纤维细胞特征(以COMP表达为标志)在血管微环境显著富集,且TGFβ活性呈现协调的空间分布模式
内皮源性Notch信号通过同时诱导TGFβ表达、抑制其受体表达,精细调控成纤维细胞的TGFβ信号传导,形成可扰动的内皮近-远转录梯度
治疗后未缓解患者出现免疫耗竭但促纤维化信号持续增强,抑制Notch/TGFβ信号可逆转RA患者类器官中纤维化相关基因/蛋白表达
研究表明,TGFβ信号驱动的促纤维化成纤维细胞扩增是导致难治性滑膜表型的关键机制,靶向该通路或可成为预防难治性RA的辅助治疗策略。
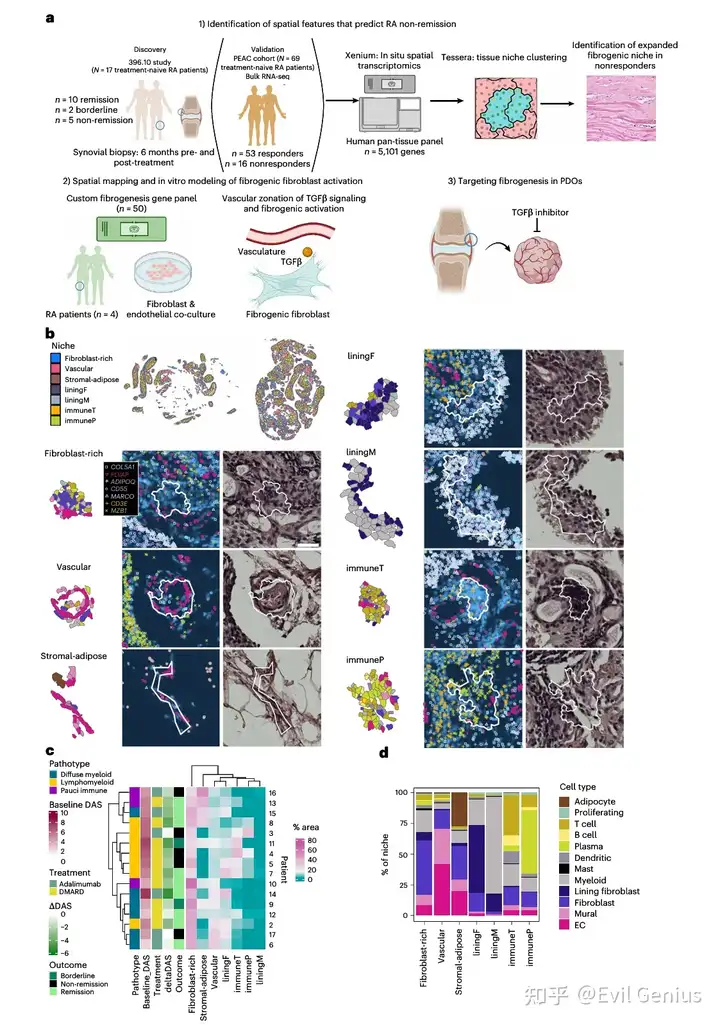
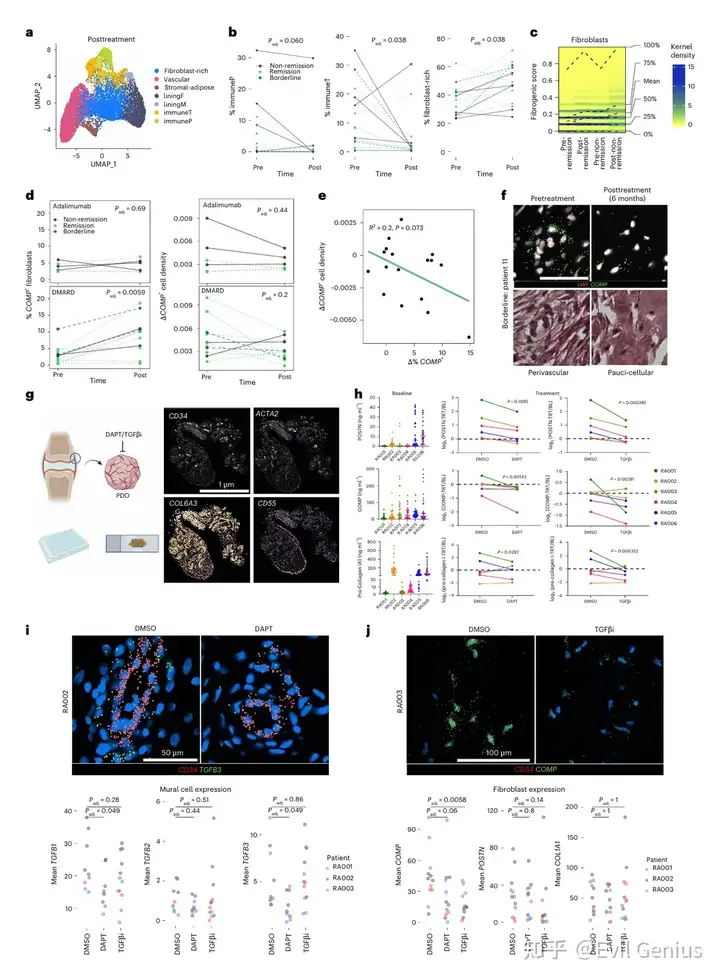
结果1、RA滑膜中不同组织微环境的鉴定
通过基于转录表达空间差异的边界划分方法,在基线样本中鉴定出七类特征明确的组织微环境:
成纤维细胞富集区:以COL6A1高表达的衬皮下层成纤维细胞为主
血管区:包含多种内皮亚型(小静脉、毛细血管、小动脉)、壁细胞(周细胞、血管平滑肌细胞)及NOTCH3+血管成纤维细胞
基质-脂肪区:嵌有血管细胞和成纤维细胞的脂肪细胞区域
衬里层成纤维细胞区:CD55+滑膜衬里层成纤维细胞
衬里层巨噬细胞区:HTRA1+衬里层巨噬细胞
T/B细胞免疫区:CD3E+ T细胞与MS4A1+ B细胞密集浸润
浆细胞免疫区:MZB1+浆细胞聚集
通过微环境组成聚类,样本可分为三类:基质-脂肪富集型(4例)、免疫微环境富集型(5例)及血管-成纤维细胞扩增型(7例)。值得注意的是:
免疫微环境区域面积与基于H&E的淋巴髓系病理分型高度一致
弥漫性髓系型与少免疫型在空间转录组分析中未呈现明确界限,提示该技术能捕捉传统组织病理评估未能揭示的细胞组织结构复杂性
成纤维细胞富集区面积与免疫区总面积呈负相关,与既往研究一致
尽管缓解组与未缓解组的基线微环境组成未呈现显著差异(可能受组织取样异质性影响),但转录水平的差异可能具有区分价值。
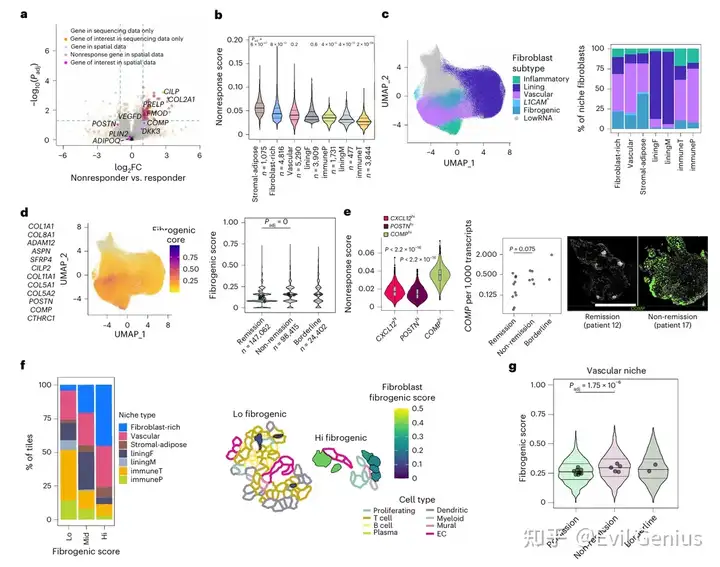
结果2、未缓解患者中促纤维化特征的升高
空间转录组分析鉴定出五种成纤维细胞亚型:
衬里层型
促纤维化型(高表达ECM基因:COL6A1、COL8A1、COMP)
炎症型(高表达CXCL12等炎症介质)
血管型(表达NOTCH3、THY1)
神经相关型(表达L1CAM)
促纤维化成纤维细胞是无应答特征富集程度最高的亚型,在无应答相关的成纤维细胞富集区、基质-脂肪区及血管区显著扩增。
基于12个促纤维化标志基因的评分在未缓解患者的基线成纤维细胞中显著升高。进一步分析显示:
RA促纤维化成纤维细胞与系统性硬化、特发性肺纤维化等纤维化疾病的肌成纤维细胞具有显著的转录组重叠
在RA间质性肺病(RA-ILD)患者的肺组织纤维化灶中,该特征同样特异性富集
在RA滑膜组织中,促纤维化特征更弥散地分布于衬里下层,高表达区域伴随更深的嗜酸性染色,提示ECM沉积增加
对单细胞数据的深入分析揭示了促纤维化成纤维细胞内部的异质性:
COMP高表达亚群:共表达DKK3、FMOD,与治疗抵抗显著相关
POSTN高表达亚群:相对富集COL1A1,其共表达基因与治疗应答正相关
CXCL12高表达炎症亚群
COMP表达是区分治疗抵抗相关促纤维化成纤维细胞的关键标志物:
COMP在未缓解患者基线样本中的升高程度远超DKK3、FMOD或POSTN
COMP+细胞数量与未缓解组6个月及12个月的压痛关节计数改善程度呈负相关
仅在血管微环境中,未缓解患者的促纤维化评分显著升高,提示血管相关的促纤维化活性可能是驱动治疗无应答的核心机制。
以COMP高表达为特征的促纤维化成纤维细胞在血管微环境中的异常活化,是导致RA治疗抵抗的重要空间病理学特征。
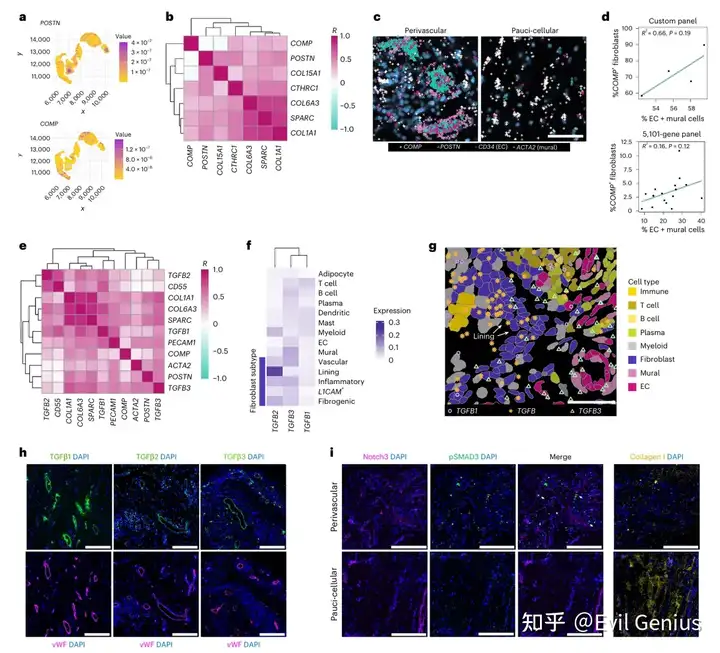
结果3、TGFβ信号在血管周围区的空间区隔化
为精确定位滑膜组织中促纤维化成纤维细胞,研究设计了包含50个基质相关基因的靶向检测组合,对新增RA滑膜样本(n=4)进行空间转录组分析。
COMP与POSTN在空间上分布于不同区域:
COMP高表达成纤维细胞主要定位于两种区域:①细胞稀少的成纤维细胞富集区;②血管周围区的远端层,环绕壁细胞和血管成纤维细胞
POSTN转录本与壁细胞标记物(ACTA2)和血管成纤维细胞标记物(COL15A1)共表达,集中于血管区域的近端细胞层
空间数据分析显示血管细胞比例与COMP表达成纤维细胞丰度呈正相关
TGFβ亚型的空间分布模式:
TGFB1:与衬里层成纤维细胞标记物CD55及内皮细胞标记物PECAM1共定位
TGFB2:与CD55强共定位,主要表达于衬里层成纤维细胞
TGFB3:不仅与内皮细胞(PECAM1)和壁细胞(ACTA2)标记物共定位,提示其在血管及血管周围富集,还与POSTN、COMP、COL1A1等促纤维化转录本广泛共表达
空间转录组数据证实:TGFB2为衬里层成纤维细胞特异性表达,TGFB1呈弥散性表达,TGFB3在基质-血管区富集
蛋白质水平验证:
免疫荧光显示TGFβ1、β2、β3蛋白均在血管周围区域定位,其中TGFβ2亦出现于免疫聚集区
pSMAD3(TGFβ信号活性标志物)仅存在于血管区域的成纤维细胞中,而在胶原沉积密集的少细胞区域缺如,表明活跃的TGFβ信号传导特异性地发生于血管区室
促纤维化基因表达与TGFβ信号均呈现明确的空间分布模式,血管周围微环境是促纤维化信号传导的重要枢纽。COMP+与POSTN+促纤维化成纤维细胞在血管周围区不同层级的定位差异,进一步揭示了该微环境的功能区隔化。
结果4、内皮细胞空间性调控TGFβ反应模式
为探究血管内皮细胞如何调控成纤维细胞中TGFβ信号的空间分布,研究通过二维(2D)和三维(3D)共培养模型,对人脐静脉内皮细胞(HUVECs)与滑膜成纤维细胞进行空间转录分析。
成纤维细胞基因表达呈近端-远端梯度分布
近内皮层成纤维细胞(紧邻内皮细胞):高表达Notch靶基因(JAG1、HES1、NOTCH3)及POSTN
远内皮层成纤维细胞(间隔一层以上细胞):Notch靶基因及POSTN表达逐渐降低,而COMP表达升高
TGFβ配体与受体的空间分布模式
配体分布:
TGFB1:在内皮细胞及近内皮层成纤维细胞高表达,远端递减
TGFB3:与TGFB1相似,在近内皮层成纤维细胞诱导表达后,在远端急剧下降
TGFB2:呈低水平弥散表达
受体分布:
TGFBR1、TGFBR2、TGFBR3的表达在近内皮层最低,并沿远端逐渐增加。
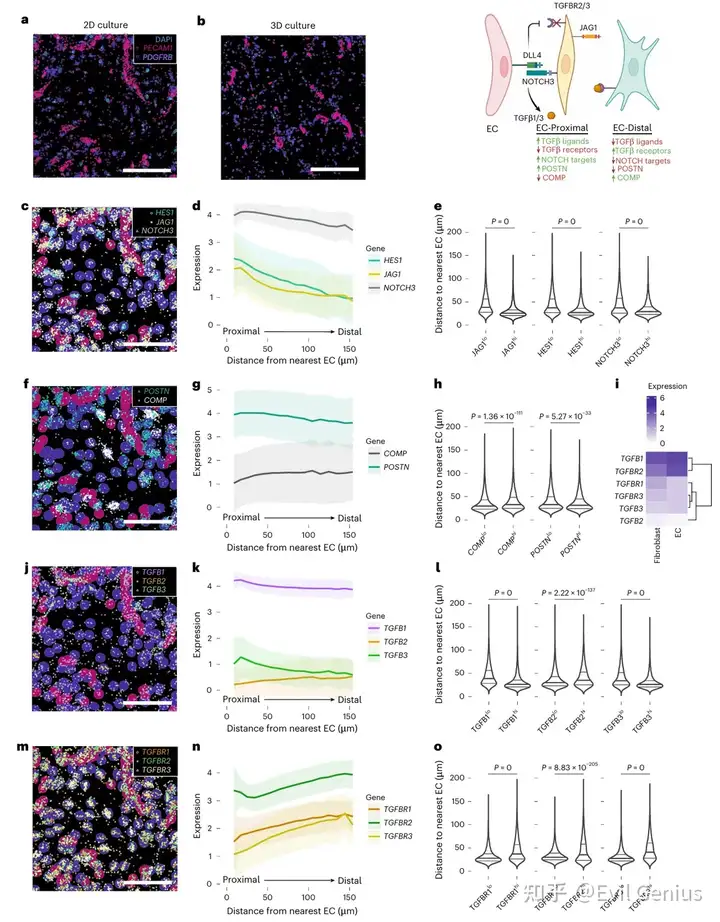
结果5、通过Notch信号调控TGFβ反应的空间模式
Notch信号是成纤维细胞TGFβ信号的上游调控因子
在含内皮细胞的3D类器官中,Notch抑制剂DAPT可逆转TGFB1/TGFB3的诱导表达及TGFBR2/TGFBR3的抑制表达
2D培养中,DLL4(Notch配体)刺激显著诱导TGFB1/TGFB3基因与蛋白表达,同时抑制TGFBR2/TGFBR3,该效应可被DAPT阻断
生物信息学分析显示TGFBR2/TGFBR3启动子区域存在Notch相关转录因子(RBPJ)结合位点
Notch通过接触依赖性方式介导TGFβ信号传导
DLL4刺激的成纤维细胞上清液中仅检测到低浓度可溶性TGFβ1
条件培养基或Transwell共培养均无法在受体成纤维细胞中诱导TGFβ响应基因
TGFβ抗体阻断对ECM产生无显著影响,提示Notch诱导的TGFβ信号主要依赖细胞接触
TGFβ亚型与受体在Notch介导的促纤维化信号中作用不同
TGFβ亚型:单基因或组合敲低均未完全抑制前胶原产生,提示三种亚型在体外具有功能冗余
TGFβ受体:
TGFBR1敲低对前胶原产生无显著影响
TGFBR2与TGFBR3敲低(尤其组合敲低)能显著抑制前胶原产生
Notch差异调控内皮近端与远端促纤维化程序
POSTN(内皮近端标志):受Notch信号增强
COMP(内皮远端标志):受Notch信号强烈抑制
两者表达均受可溶性TGFβ诱导,且可被TGFBR2/TGFBR3敲低削弱
内皮细胞通过Notch信号以接触依赖性方式双向调控成纤维细胞的TGFβ信号——近端诱导配体表达同时抑制受体表达,从而形成TGFβ反应性的空间梯度。Notch对COMP与POSTN的相反调控作用进一步揭示了其塑造成纤维细胞功能异质性的新机制。
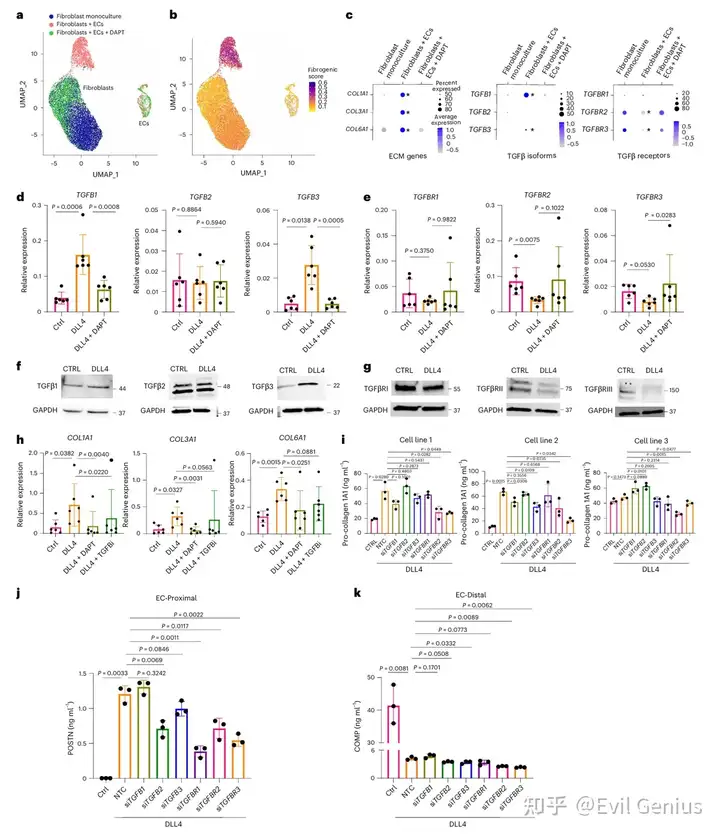
共培养条件下成纤维细胞持续高表达PRO-COL1和POSTN(可被DAPT或TGFβi抑制),而COMP表达随时间显著下降,且该抑制效应与内皮比例呈正相关。进一步研究发现,COMP的抑制趋势与TGFβRII/RIII的内皮比例依赖性下调同步,提示成纤维细胞TGFβ受体可用性变化可能形成其响应TGFβ的动态阈值。组织学数据证实COMPhi成纤维细胞的TGFBR2/R3表达显著高于POSTNhi细胞。通过慢病毒过表达实验发现,过表达TGFBR3(而非TGFBR2)能显著缓解内皮细胞对COMP的抑制作用,并增强POSTN的持续表达,表明TGFβRIII的可及性特异性介导了内皮Notch信号对TGFβ反应性的空间模式调控。
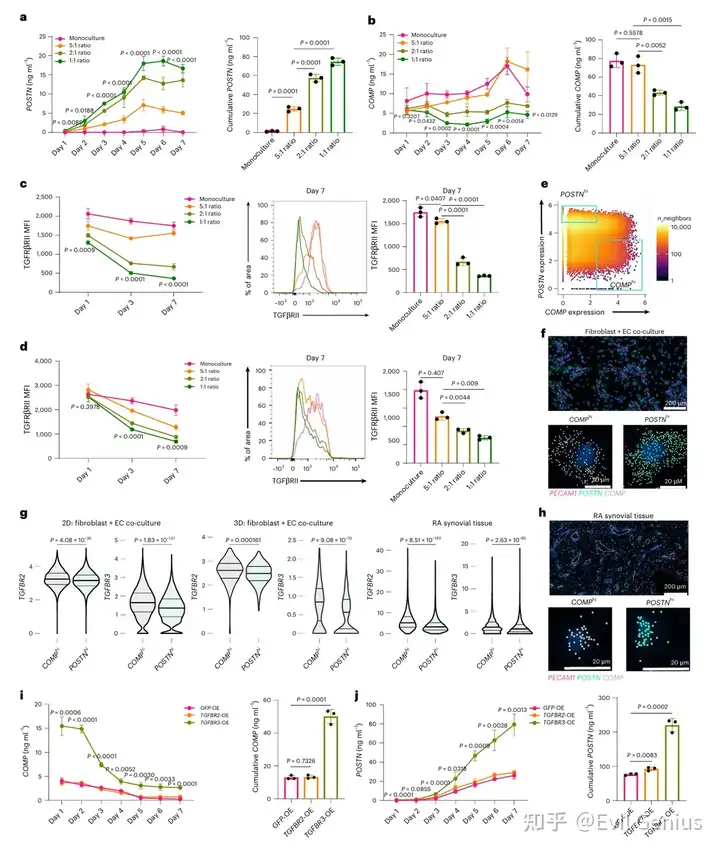
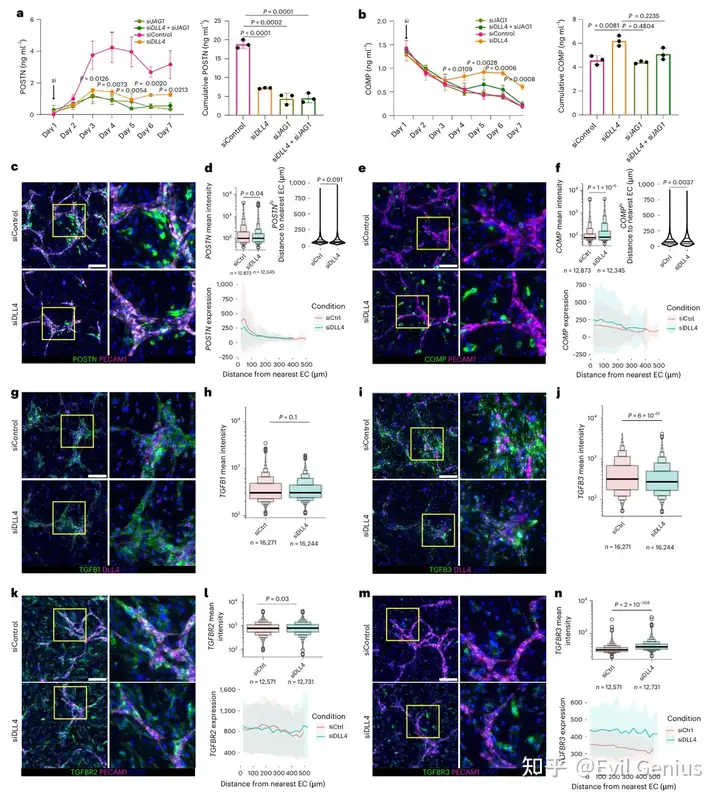
结果5、Notch信号破坏诱导促纤维化激活
Notch配体敲低引发基因表达时序变化
敲低内皮特异性配体DLL4或成纤维细胞表达的JAG1(或两者同时敲低)均显著抑制POSTN表达
DLL4敲低条件下:COMP表达在第3天前被抑制,但从第4天开始出现去抑制性上调
空间分布模式的改变
DLL4敲低后:COMP表达显著诱导(P=1.4×10⁻⁶),POSTN表达减弱(P=0.04)
POSTN表达模式无显著空间变化(因其本就局限在内皮近端)
COMP表达:平均表达量升高,且COMP高表达细胞与内皮细胞的平均距离增加
TGFβ通路相关分子的变化
TGFBR3表达:平均表达显著升高,且在内皮近端和远端区室均上调
TGFB3表达:平均表达下降
TGFB1和TGFBR2的表达模式无显著改变
机制阐释
COMP表达成纤维细胞的扩增与TGFβRIII的去抑制(由DLL4敲低介导)特异性相关,而非TGFβ表达增加所致
内皮Notch信号通过调控TGFβ受体表达来指导促纤维化信号的空间分布
体内验证
滑膜组织血管微环境中,TGFBR3表达与Notch转录靶标评分呈负相关,支持Notch在体内抑制TGFβ受体表达的作用
Notch信号通过调控TGFβ受体(尤其是TGFβRIII)的表达水平,动态调节血管微环境中成纤维细胞对TGFβ的敏感性。破坏稳态Notch信号会导致远端促纤维化程序(COMP表达)的去抑制,从而改变促纤维化活性的空间分布模式。
结果6、治疗后促纤维化微环境的扩增
治疗后RA滑膜出现免疫耗竭伴随促纤维化微环境扩增的病理重构,COMP+成纤维细胞的活化与组织纤维化进展相关。靶向Notch或TGFβ信号能有效抑制该促纤维化过程,为治疗难治性RA提供了潜在新策略。
看看方法部分


生活很好,有你更好。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
评论
登录后参与评论
推荐阅读
目录

