文献分享--IGSF11-VISTA 是弥漫性中线胶质瘤中一个关键且可靶向的免疫检查点通路
原创文献分享--IGSF11-VISTA 是弥漫性中线胶质瘤中一个关键且可靶向的免疫检查点通路
原创
追风少年i
发布于 2026-01-26 10:06:12
发布于 2026-01-26 10:06:12
作者,Evil Genius
农村老家躺平中。。。
最近两天一直在同学的台球厅里待着,管吃管住免费玩,想几点睡几点睡,想赖床就赖床,连lol都在同学的带领下都破天荒的上了白金了,昨天通宵了一晚上,一直睡到下午4点多,要是可以一直这样就好了,有没有哪位大神突然也资助我200多万,在我同学旁边开个棋牌室?可惜美好的时光总是短暂的。
最近也和一些学员简单聊了聊,有一些确实比较焦虑,在这个几乎是唯“文章论”的背景下,大家都想尽快出一篇文章,帮助自己留院或者稳固自己的“地位”,但是科研这种事情是不可能批量化“生产”的,必须做出innovation,也就是0-1,而且对大家是一种综合性的能力,包括课题设计、样本搜集、数据分析、英文水准、实验能力等,其中几乎所有的能力都需要大家背靠课题组,日积月累,稳中求胜,都说读博要脱三层皮,真的不是说说而已。
等工作了以后,尤其进了公司以后要和生活对线了,追求标准化、规模化,这种0-1的innovation也就几乎再也不可能了。
我虽然不是医学专业,但对医学还是很敬畏的。
今天我们分享文献
知识积累
弥漫性中线胶质瘤(Diffuse Midline Glioma) 是一种生长在脑或脊髓中线结构的恶性肿瘤,属于中枢神经系统胶质瘤。 它具有 侵袭性强、边界不清、治疗困难 的特点,常见于儿童及青少年,预后较差。 DMG通常以组蛋白H3第27位赖氨酸突变为甲硫氨酸(H3K27M)为特征,其中最常见的是H3.3K27M变异体。这一K27M突变常伴随其他癌基因和抑癌基因的突变,其中TP53突变和PDGFRA扩增与H3.3K27M最为密切相关。
TME既可受肿瘤影响,又能反过来促进肿瘤异质性,并对胶质瘤的生长起至关重要的作用。
髓系细胞通过与肿瘤细胞积极互作,营造出免疫抑制微环境,从而支持肿瘤持续生长。
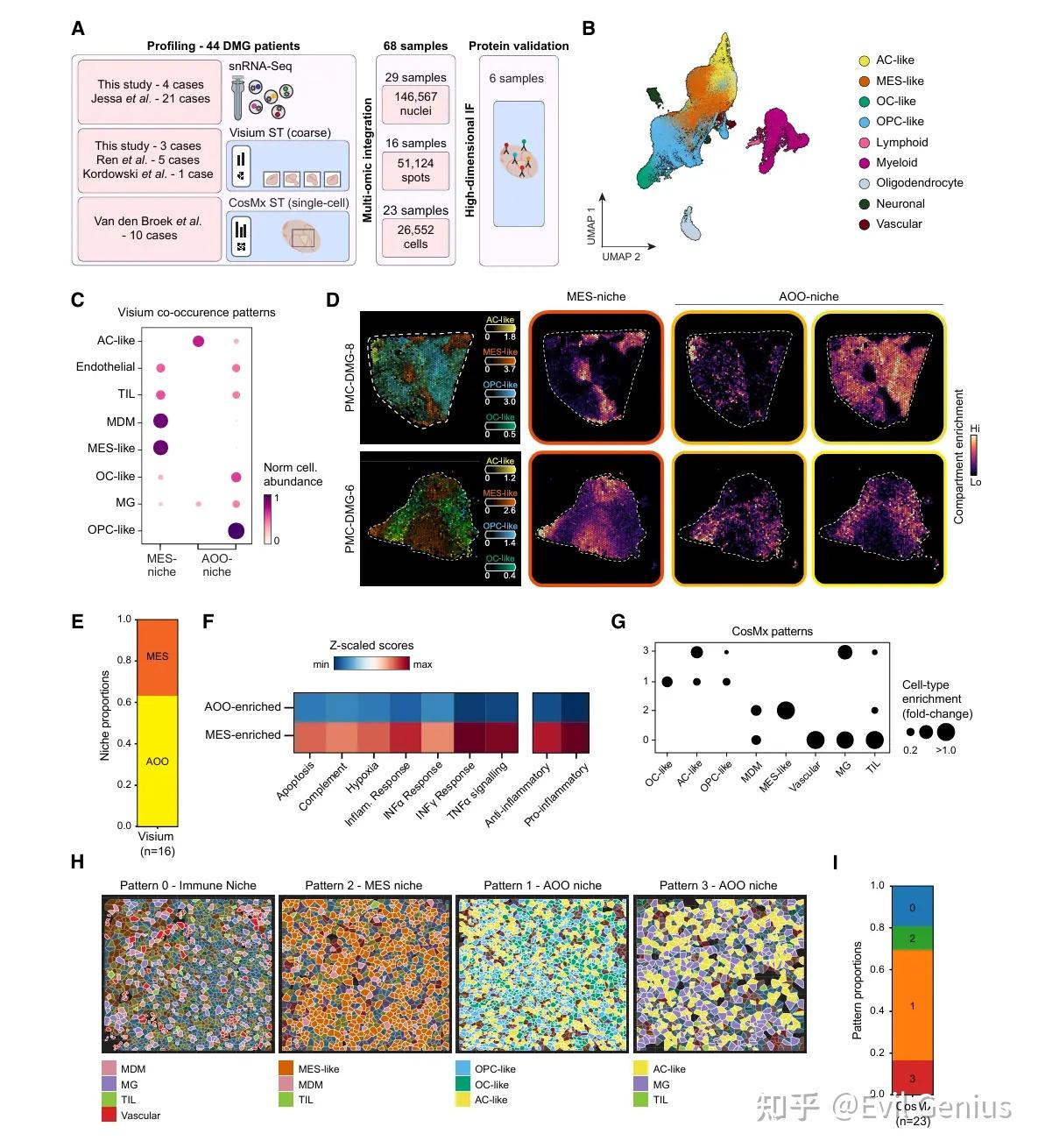
结果1、多模态分析识别出DMG中肿瘤和免疫细胞相互依存的两种空间模式
snRNA + Visium + CosMx + IF。
为评估这些免疫细胞与肿瘤细胞亚群在空间上的共现关系,首先分析了16例Visium样本,结果揭示出三种不同的肿瘤-免疫微环境:
MES微环境(MES-niche):富含恶性间充质(MES)程序的区域,其特征是血液来源免疫细胞的浸润,包括单核细胞来源的巨噬细胞(MDMs)和TILs,这一模式与成人胶质母细胞瘤(GB)中观察到的现象一致。与GB类似,这些区域显著富集缺氧信号以及促炎介质通路(如IFNγ、IFNα和TNFα通路),提示活跃的免疫细胞招募和潜在激活状态。然而,考虑到在癌症(包括高级别胶质瘤)中缺氧常与免疫抑制和T细胞耗竭相关,我们在促炎反应附近也检测到了抗炎信号。因此,MES区域呈现出免疫激活与抑制之间的动态平衡,可能促进免疫细胞募集,同时限制T细胞的有效功能。
全组织3D成像进一步证实,当T细胞被招募至肿瘤时,它们往往紧密聚集于局部“热点”区域。这些热点区域的T细胞几乎不向周围组织扩散,支持存在主动机制限制T细胞向肿瘤实质浸润的观点。
AOO微环境(AOO-niche):其余约60%的空间映射区域对应于富含发育样程序(AC-、OPC-和OC-like)的微环境,这些区域形成两种交织分布的模式,统称为AOO微环境。与MES微环境不同,AOO区域以小胶质细胞富集为特征,几乎不含MDMs,且T细胞数量更少。
利用CosMx单细胞分辨率数据集,进一步验证了MDMs选择性富集于MES区域,并明确发现小胶质细胞主要与以AC样细胞为主的AOO样区域共定位。
值得注意的是,尽管Visium数据显示血液来源免疫细胞主要浸润MES区域,但更高分辨率的分析揭示了第三种空间模式:即TILs、MDMs和小胶质细胞共同围绕血管分布,提示局部存在免疫-血管相互作用。
总结一下:在DMG中鉴定出三种空间上截然不同的肿瘤-免疫生态系统:
MES区域:富集血液来源的MDMs,并包含反映局部免疫-血管互作的离散区域;
AOO区域(占主导地位):富集脑内固有小胶质细胞,血液来源免疫细胞浸润极少;
血管相关模式(模式0):TILs、MDMs与小胶质细胞共同定位于血管周围。
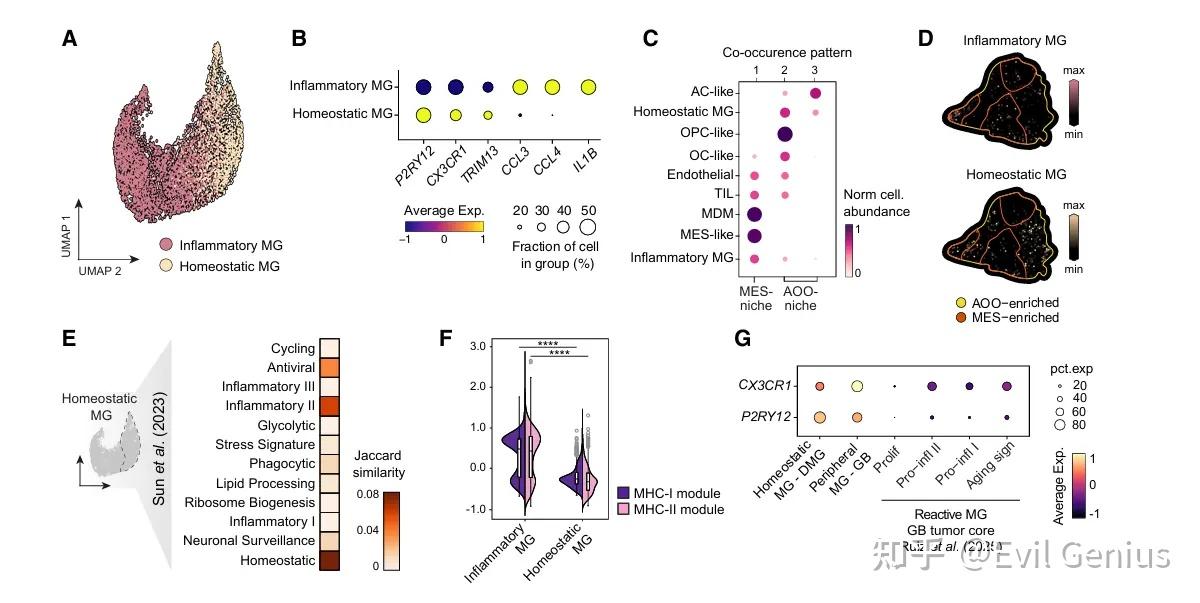
结果2、位于AOO区域的小胶质细胞类似于稳态小胶质细胞,并表现出与血液来源免疫细胞极少浸润相一致的特征
在弥漫性中线胶质瘤(DMG)中,小胶质细胞根据其所在空间区域呈现出显著不同的表型:
AOO区域(富含发育样肿瘤细胞)中的小胶质细胞表现为类稳态表型:高表达稳态标志物(如P2RY12和CX3CR1),MHC-I/II表达水平低,缺乏炎症因子和趋化因子的表达,提示其抗原呈递能力弱、免疫激活程度低。这种状态与该区域极少有血液来源免疫细胞浸润的现象一致。
MES区域(间充质样肿瘤区域)则富集炎症性小胶质细胞:表达IL1B、CCL3、CCL4等促炎因子,具有典型的免疫激活特征。
与成人胶质母细胞瘤(GB)不同——在GB中稳态小胶质细胞仅存在于肿瘤边缘,瘤内几乎全为炎症性小胶质细胞——DMG的肿瘤核心广泛存在类稳态小胶质细胞,尤其与AOO样肿瘤细胞共定位。
这一发现揭示了DMG独特的免疫微环境结构:其肿瘤内部保留了大量接近生理状态的小胶质细胞,而非全面炎症化。这种空间和功能上的异质性不仅深化了对DMG免疫生态的理解,也为开发靶向特定小胶质细胞-肿瘤互作(如IGSF11-VISTA轴)的治疗策略提供了重要依据。
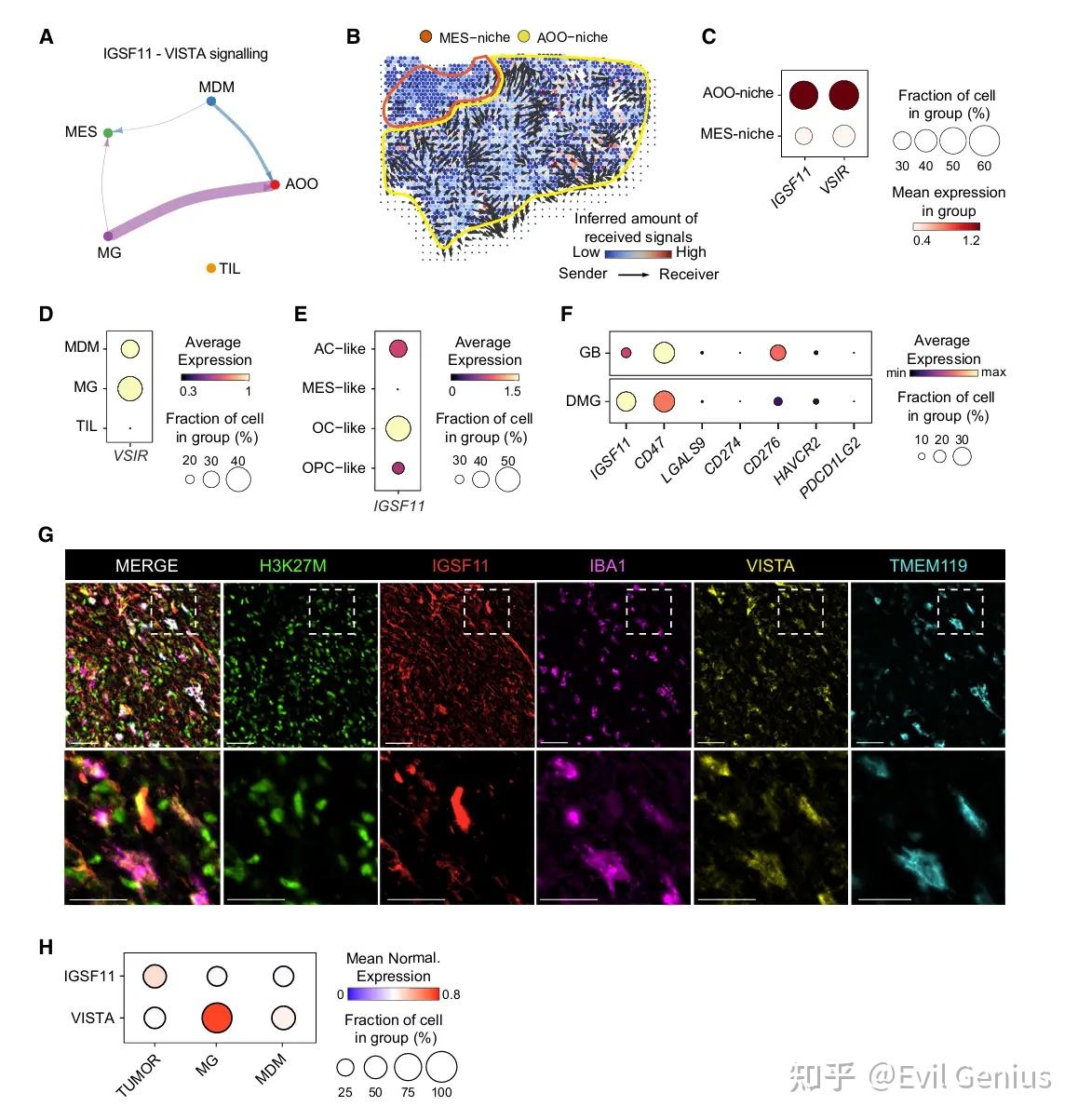
结果3、IGSF11-VISTA通路在DMG的AOO区域显著富集,构成潜在治疗靶点
分析单细胞核RNA测序(snRNA-seq)数据,系统预测了DMG中免疫细胞与肿瘤细胞之间的配体-受体(L-R)相互作用。分析发现,小胶质细胞是关键信号发送者之一,尤其在“模式2”中主导了多种免疫调控通路,其中包括多个免疫检查点分子,如TIM-3、GALECTIN,以及一个此前被低估的通路——VISTA(VSIR)与其配体IGSF11(VSIG3)。
空间特异性互作:
IGSF11-VISTA信号主要发生在AOO样肿瘤细胞与小胶质细胞之间。空间转录组分析(Visium)和空间通讯工具(COMMOT)进一步证实,该通路在AOO区域高度富集,且存在强烈的配体-受体空间共定位。
细胞来源明确:
VISTA(VSIR) 主要由小胶质细胞表达(与健康脑组织一致),单核来源巨噬细胞(MDMs)也有一定表达;
IGSF11 则主要由AC样、OC样和OPC样肿瘤细胞(即AOO谱系)表达。
在DMG中高表达:
与其他已知免疫检查点(如PD-L1、PD-L2、B7-H3、CD47)相比,IGSF11在DMG患者样本中的表达水平最高,甚至超过被认为有治疗潜力的CD47。这一现象在成人胶质母细胞瘤(GB)中并不明显,凸显其在儿童胶质瘤中的特异性。
蛋白水平验证:
免疫荧光成像确认:肿瘤细胞表达IGSF11,小胶质细胞(及部分MDMs)表达VISTA。
公共数据库支持。
IGSF11-VISTA构成了一条DMG特异、空间受限、且高度活跃的免疫检查点轴,连接AOO样肿瘤细胞与稳态样小胶质细胞。鉴于其高表达、特异性及可靶向性,该通路有望成为治疗DMG乃至其他儿童胶质瘤的新策略,尤其适用于T细胞浸润稀少、依赖髓系免疫调控的肿瘤微环境。
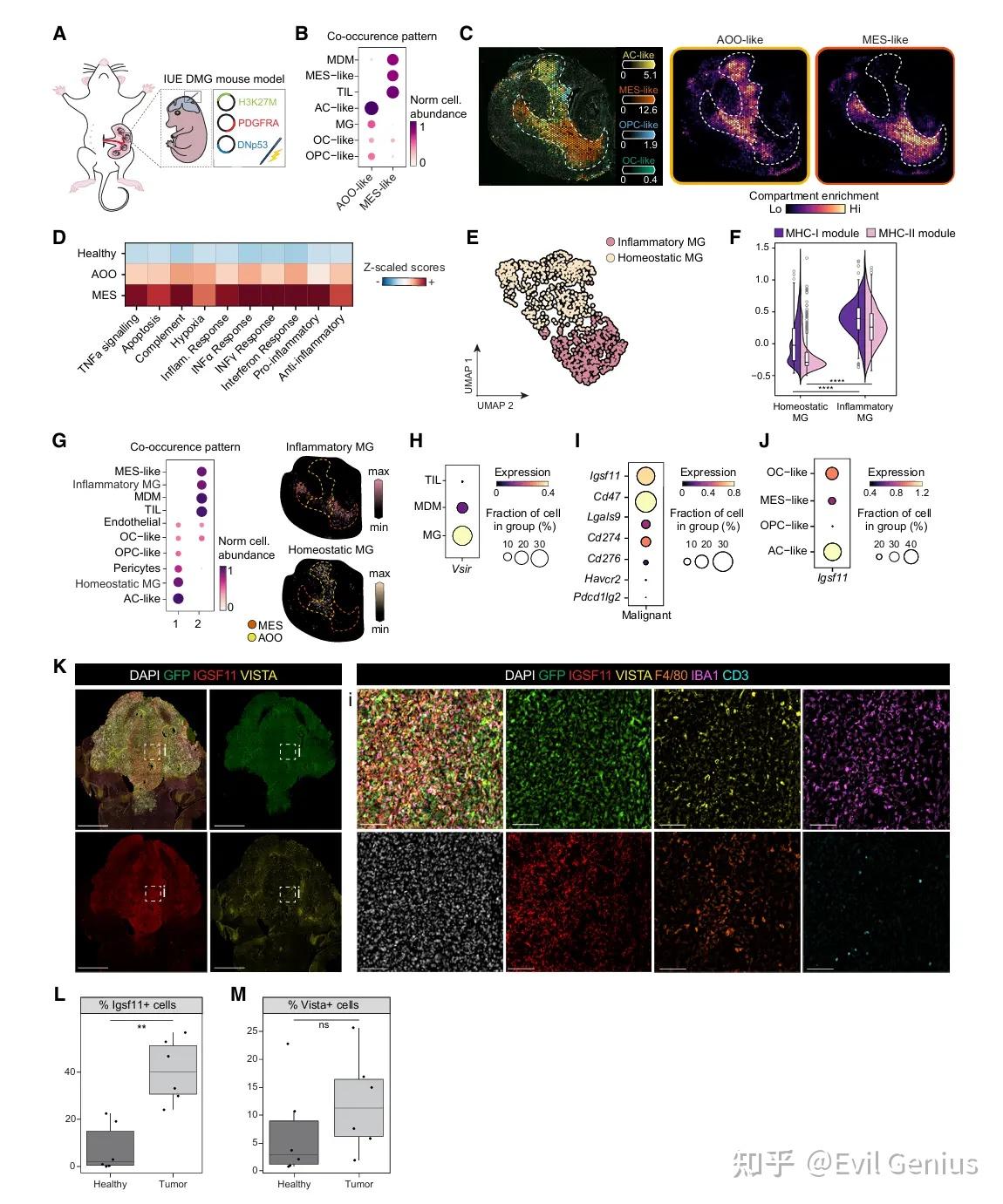
结果4、IGSF11-VISTA 是一种在免疫健全小鼠模型中可重现的保守机制,适用于功能验证
IUE 小鼠模型稳定地再现了人类 DMG 的细胞异质性、免疫微环境构成及空间组织结构,特别是 IGSF11-VISTA 轴在 AOO 区域的保守性。因此,该模型为实验性验证靶向 IGSF11-VISTA 通路的治疗效果提供了高度相关且可靠的体内平台,支持其作为 DMG 特异性免疫治疗策略的进一步开发。
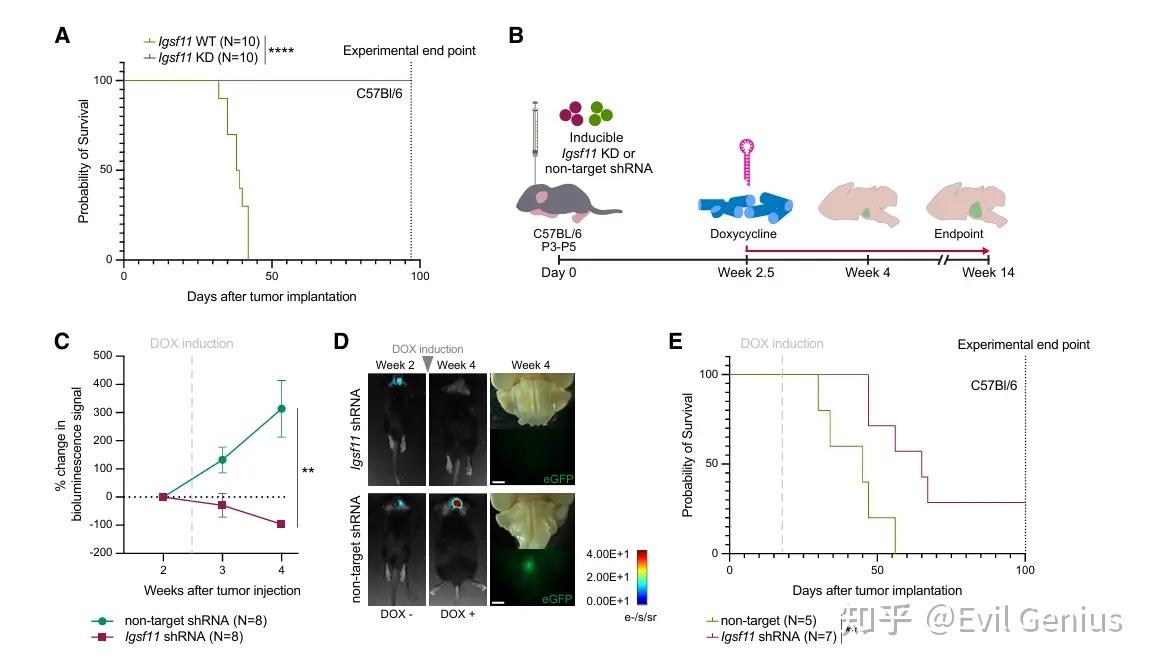
结果5、敲低 Igsf11 可显著抑制 DMG 肿瘤生长并大幅延长生存期
靶向 IGSF11-VISTA 通路具有显著治疗潜力
无论是通过可诱导的基因沉默还是VISTA 阻断抗体,靶向 IGSF11-VISTA 免疫检查点轴均能在已形成的肿瘤中发挥强大抗肿瘤作用,显著抑制肿瘤生长并延长生存期。
该通路在小鼠模型和人类患者样本中均有效,且作用机制不依赖 T 细胞,特别适合 DMG 这类免疫“冷”肿瘤。
因此,IGSF11-VISTA 是一个极具前景的、可转化的治疗靶点,支持进一步开发针对该通路的抗体或小分子抑制剂用于儿童弥漫性中线胶质瘤的临床治疗。
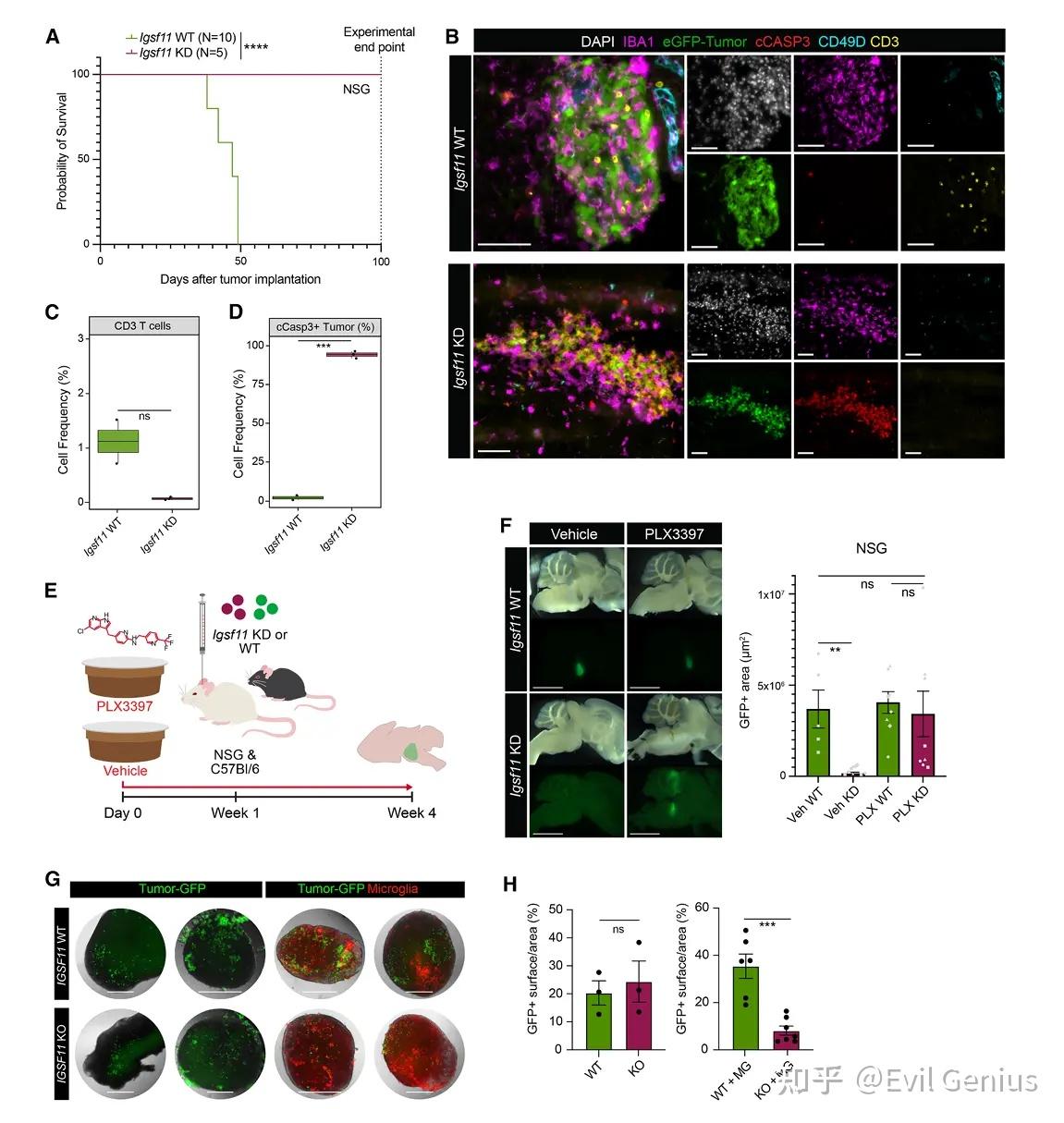
结果6、IGSF11 缺失介导的肿瘤清除依赖于脑内固有小胶质细胞
肿瘤清除完全依赖于脑内固有的小胶质细胞,而非外周招募的免疫细胞(如T细胞或单核来源巨噬细胞)。
IGSF11-VISTA 通路通过抑制小胶质细胞的抗肿瘤功能(如吞噬和诱导凋亡)来维持 DMG 生长。
一旦阻断该通路(通过基因敲除或抗体阻断),脑内固有小胶质细胞即可被激活,直接识别并清除肿瘤细胞,整个过程不依赖T细胞或其他外周免疫细胞。
这一机制在小鼠和人类模型中高度保守,为开发以小胶质细胞为中心的免疫治疗策略提供了坚实基础,尤其适用于传统免疫疗法(如PD-1/PD-L1抑制剂)无效的“免疫冷”型儿童脑瘤——DMG。
结果7、IGSF11 通过正反馈强化小胶质细胞 VISTA 表达,维持其稳态表型,从而抑制抗肿瘤免疫
IGSF11-VISTA 不仅是肿瘤逃避免疫监视的“刹车”通路,更是主动维持小胶质细胞稳态的关键信号轴。
肿瘤细胞通过分泌 IGSF11,诱导小胶质细胞高表达 VISTA,形成正反馈;
这一互作将小胶质细胞“固定”在非炎症、低抗原呈递的稳态状态,抑制其抗肿瘤功能;
一旦阻断该通路(如敲低 IGSF11 或阻断 VISTA),小胶质细胞即可脱离稳态,恢复吞噬与促凋亡能力,从而清除肿瘤。
靶向 IGSF11-VISTA 并非激活传统炎症反应,而是解除对脑内固有免疫细胞(小胶质细胞)的功能抑制,触发一种非炎症性的、脑内源性的肿瘤清除机制——这为治疗免疫“冷”型儿童脑瘤 DMG 提供了一条安全且高效的全新路径。
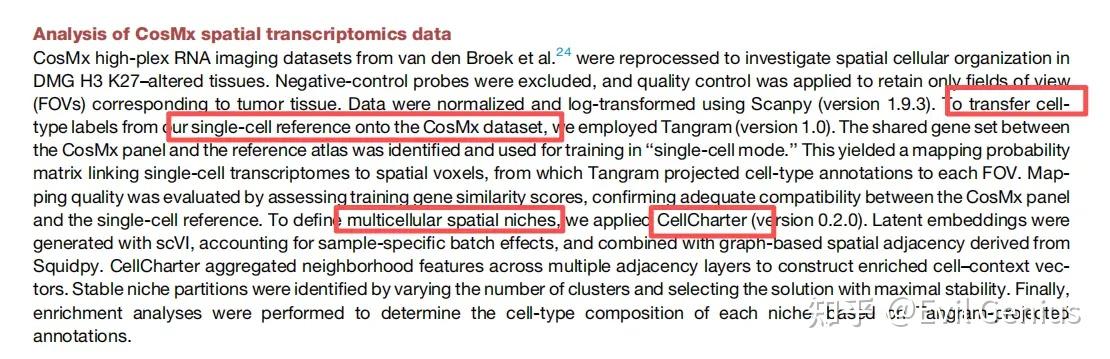
最后来看看方法

生活很好,有你更好。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
评论
登录后参与评论
推荐阅读
目录

