Nat. Mach. Intell. | 生物信息约束的双分支Transformer用于药物诱导细胞扰动建模
Nat. Mach. Intell. | 生物信息约束的双分支Transformer用于药物诱导细胞扰动建模

DrugAI
发布于 2026-02-04 12:09:57
发布于 2026-02-04 12:09:57
系统刻画药物诱导的细胞转录扰动响应对于多靶点药物发现至关重要,但受限于实验规模与数据稀缺。研究人员提出了一种生物知识引导的双分支Transformer模型——XPert,用于精准建模基因层级的扰动效应及其剂量—时间动态变化。该模型通过分别编码扰动前与扰动后的细胞状态,将内在转录结构与外源药物调控效应解耦,并引入知识图谱连接药物化学特征与生物机制。在多个评测场景中,XPert在相关性与误差指标上显著优于现有方法,并能够解析药效动力学轨迹、迁移学习至临床数据,同时提供机制可解释性,成功识别药物耐药相关生物标志物。

现代药物发现已从“单药单靶点”模式转向“单药多靶点”调控框架。药物往往同时作用于多个分子通路,引发复杂级联反应与多样表型结果。
大规模扰动转录组数据为解析药物作用机制提供了重要资源,但存在关键挑战:
- 高质量扰动数据稀缺,尤其是临床场景;
- 批次效应与噪声干扰机制解析;
- 多数模型忽略剂量与时间依赖性;
- 化学特征与生物响应之间缺乏有效桥接。
传统VAE模型虽具去噪能力,却容易过度平滑,掩盖真实生物信号;注意力模型则往往忽略细胞背景信息。
方法
研究人员构建了XPert双分支Transformer框架:
双分支结构
- 基础分支(Base encoder):建模扰动前细胞内基因—基因调控关系;
- 扰动分支(Perturb encoder):通过交叉注意力捕捉药物—基因交互及条件依赖效应。
多模态输入
- 药物化学特征(3D分子表示模型提取);
- 药物生物特征(基于药物—靶点、PPI、结构相似性的知识图谱);
- 剂量与时间条件token。
训练策略
- 在大规模预临床数据集上预训练;
- 在小规模临床数据上微调迁移。
结果
整体架构与评测框架
XPert可同时预测:
- 扰动后基因表达谱
- 基因表达变化量
并在未见细胞、未见药物与未测剂量—时间条件下进行泛化评测。
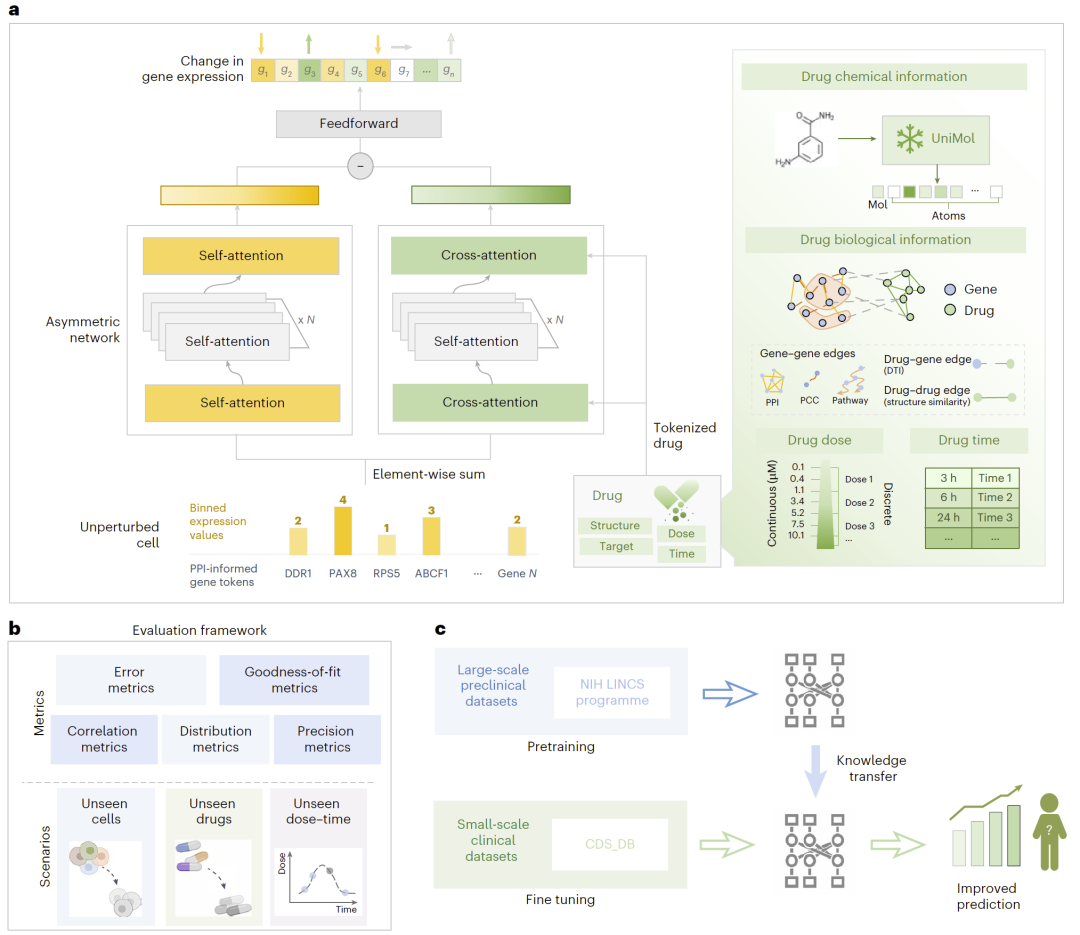
图1|XPert模型整体框架。
单剂量单时间预测性能显著领先
在标准扰动预测任务中:
- XPert在Pearson相关系数、误差指标与分布指标全面优于VAE与注意力模型;
- 在“冷细胞”泛化场景中提升尤为显著。
并准确捕捉关键高变基因的表达趋势。
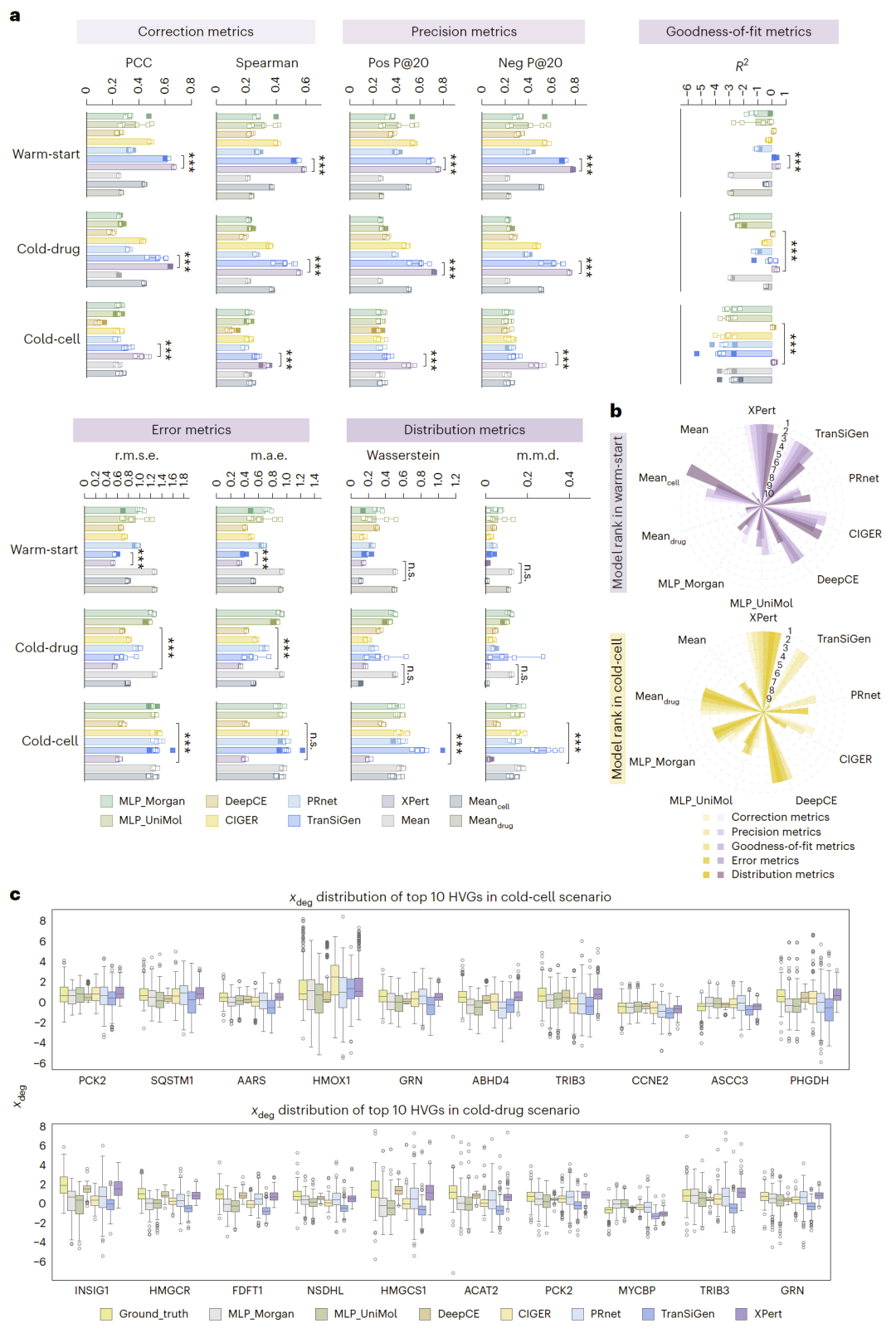
图2|单剂量单时间(sdst)场景下XPert与基线模型的性能对比。
生物知识增强泛化能力与可解释性
XPert成功:
- 缓解批次效应,保持细胞类型生物一致性;
- 通过知识图谱构建生物空间嵌入,使相同作用机制药物自然聚类;
- 注意力权重突出关键药效结构片段(如EGFR抑制剂核心结构)。
展现明确的结构—功能关联。
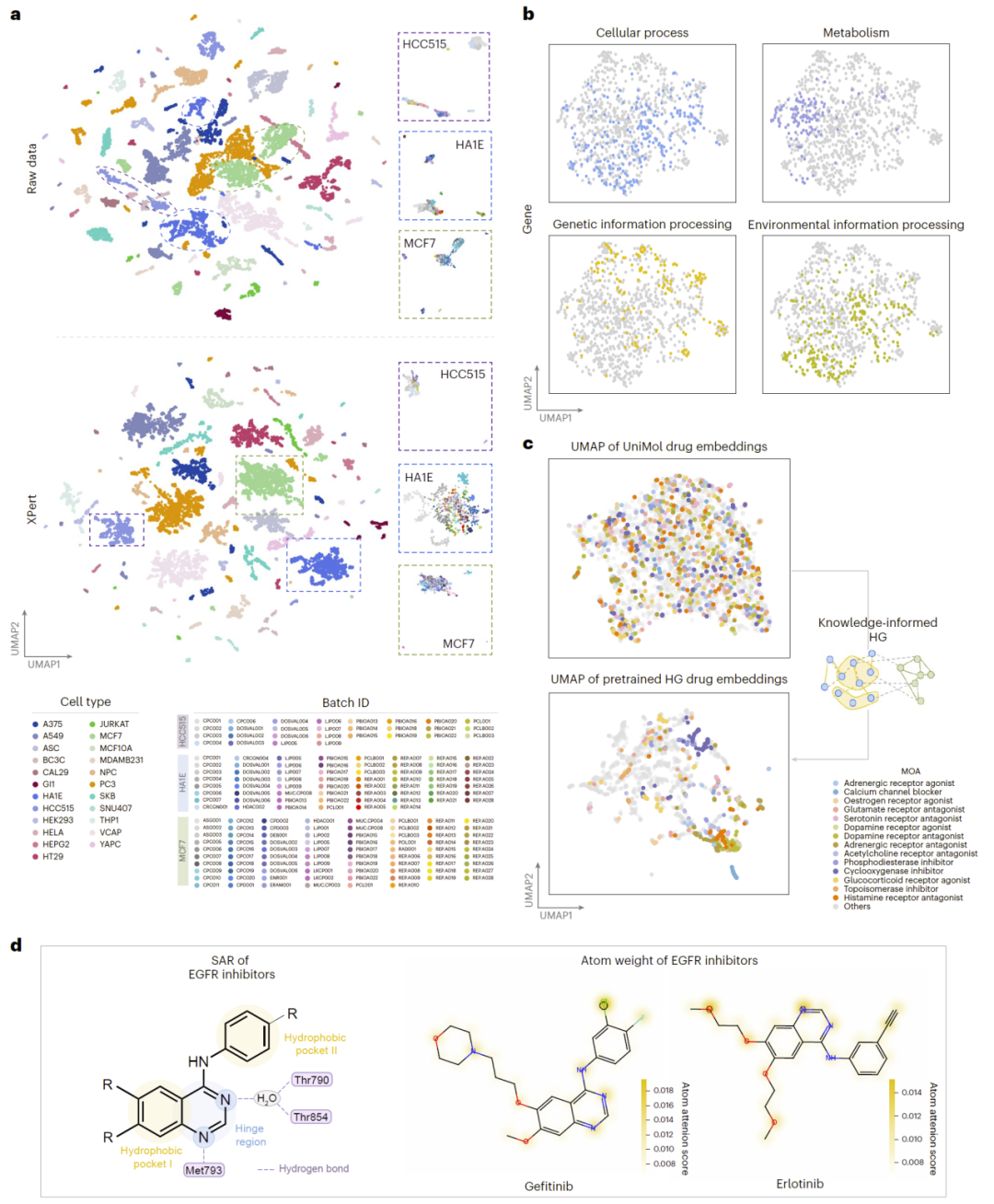
图3|XPert中的生物知识建模与可解释性分析。
多剂量多时间动态响应建模
在真实药效动力学场景中:
- XPert成功建模复杂剂量—时间响应曲面;
- 准确还原基因特异性剂量反应模式;
- 揭示不同基因在不同浓度与时间窗口的动态调控差异。
例如HDAC抑制剂在不同剂量下引发转录反应反转现象。
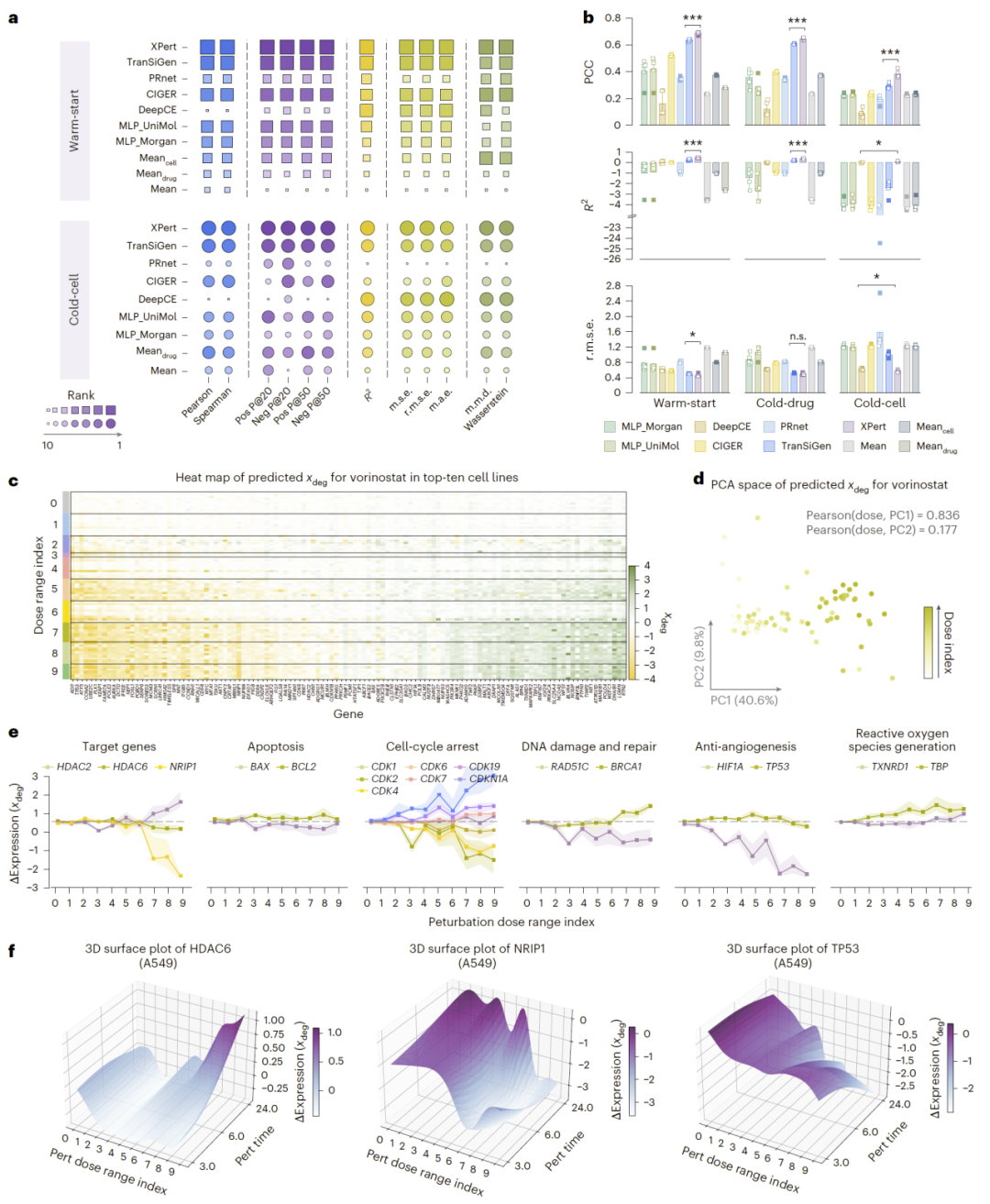
图4|多剂量多时间(mdmt)场景下的性能评测与动力学分析。
小样本学习补全未测条件
由于多数扰动数据仅包含单剂量或单时间点,研究人员提出:
- 预训练 + 少样本微调策略;
- 利用少量实验点推断完整剂量—时间响应景观。
结果显示:
- 一次采样可大幅提升未测条件预测精度;
- 显著降低实验成本。
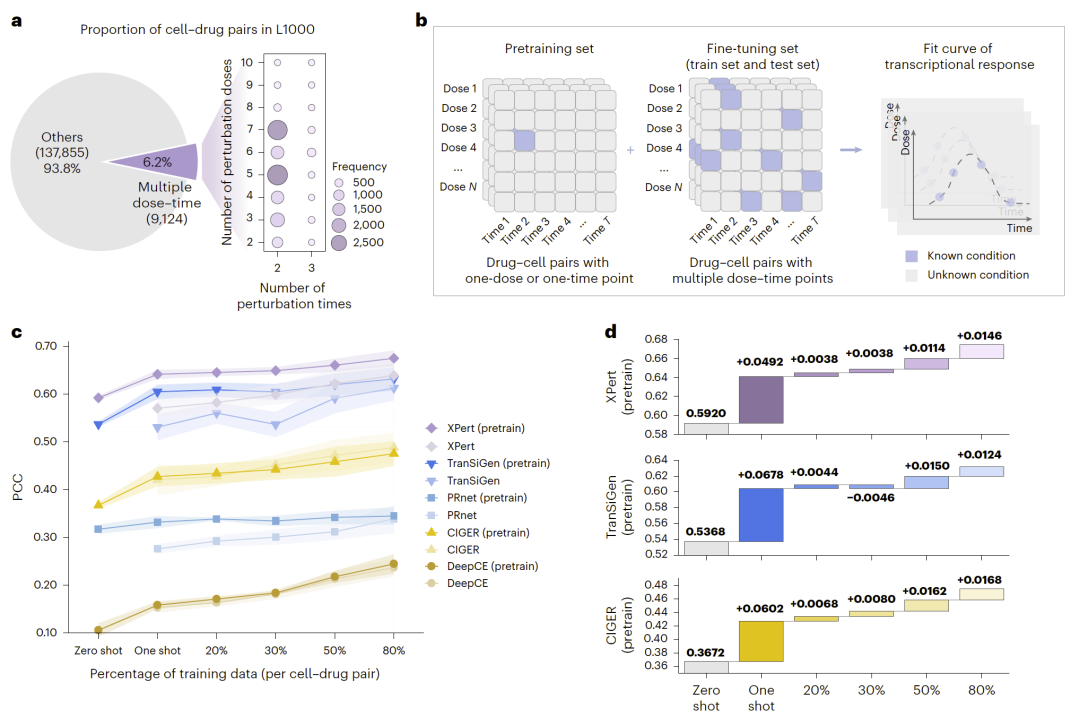
图5|基于少样本学习提升未测剂量—时间条件预测性能。
预临床到临床的知识迁移
通过在大规模预临床数据上预训练,XPert成功迁移至患者转录组预测:
- 在乳腺癌与白血病中显著提升预测相关性;
- 准确捕捉极端表达变化。
同时通过注意力分析识别多个耐药相关关键基因,部分在传统差异表达分析中不可见。
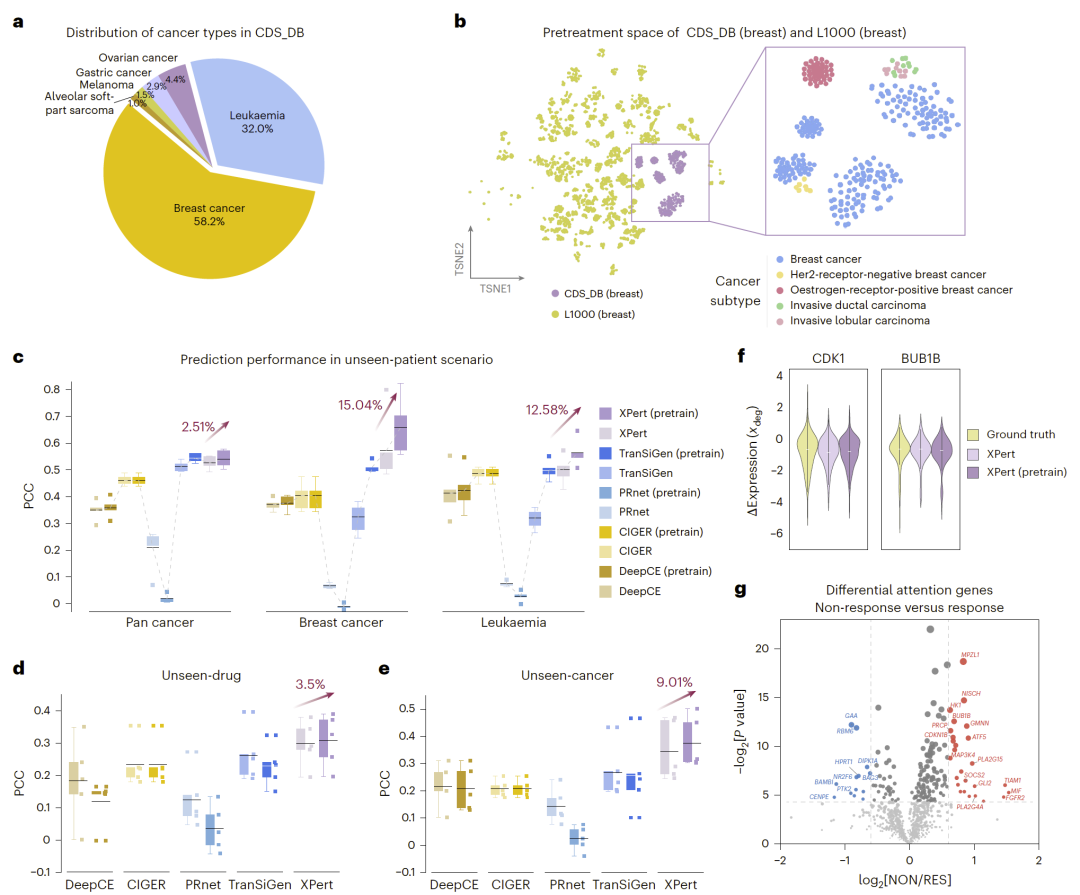
图6|通过迁移学习实现预临床数据向临床预测的桥接。
讨论
研究人员提出的XPert框架在多个层面实现突破:
方法学创新
- 双分支解耦扰动前后状态;
- 知识图谱桥接化学—生物空间;
- 条件token建模非线性剂量—时间关系。
性能优势
- 显著优于VAE与传统注意力模型;
- 在泛化场景稳定性突出;
- 支持动态响应解析。
实际意义
- 构建完整药物扰动动力学图谱;
- 减少高成本实验需求;
- 支持临床个体化响应预测。
未来研究可拓展至:
- 单细胞层级扰动预测;
- 多组学整合;
- 生物大分子与遗传扰动场景。
整理 | DrugOne团队
参考资料
Guo, Y., Zhang, H., Hu, H. et al. Modelling drug-induced cellular perturbation responses with a biologically informed dual-branch transformer. Nat Mach Intell 8, 96–112 (2026).
https://doi.org/10.1038/s42256-025-01165-w
内容为【DrugOne】公众号原创|转载请注明来源
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2026-01-31,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

